Reactivo limitante
Aquel reactivo que se ha consumido por completo en una reacción química
se le conoce con el nombre de reactivo limitante pues determina o limita la
cantidad de producto formado.
Similador 1
Simulador 2
CÁLCULOS DE REACTIVO LIMITANTE A PARTIR DE MOLES
Ejemplo:
Se necesita un cierre, tres arandelas y dos tuercas para construir una
baratija. Si el inventario habitual es 4,000 cierres, 12,000 arandelas y 7,000
tuercas. ¿Cuantas baratijas se pueden producir?
La ecuación correspondiente será:
Primer paso: Halle la relación molar. En esta reacción se hace referencia
a 1 mol de cierres, 3 moles de arandela y 2 moles de tuercas reaccionan para
dar 1 mol de baratijas.
Segundo paso: Divide la cantidad que te dan de cada reactivo por
el número de moles de ese reactivo (Coeficiente) que se usan en la ecuación
ajustada, para determinar la cantidad de cada reactivo para la ecuación química especifica.
Cierres: 4,000 / 1 = 4,000
Cierres: 4,000 / 1 = 4,000
Arandelas: 12,000 / 3 = 4,000
Tuercas: 7,000 / 2 = 3,500
El que da menor cantidad es el Reactivo limitante y los demás
son reactivos en exceso
Por tanto, el reactivo limitante del ejemplo es la tuerca.
Tercer paso: Se determina el número de baratijas que pueden hacerse a
partir del reactivo limitante. Ya que el reactivo limitante es la tuerca, el
máximo número de baratijas que pueden hacerse viene determinado por el número
de tuercas.
Entran dos tuercas en cada baratija, de modo que el número de baratijas que pueden producirse, de acuerdo con la estequiometria del proceso es:
Entran dos tuercas en cada baratija, de modo que el número de baratijas que pueden producirse, de acuerdo con la estequiometria del proceso es:
7,000 / 2 = 3,500 x 1 baratija = 3,500 baratijas
Ejercicio:
1. Para la
reacción:
¿Cuál es el
reactivo limitante si tenemos 10 moléculas de hidrógeno y 10 moléculas de
oxígeno?
Actividad 1
1. Considere la
siguiente reacción:
Supongamos
que se mezclan 63 moles de NH3 con 114 moles de CO2.
¿Cual es el
reactivo limitante?
¿Cual es el
reactivo en exceso?
¿Cuántas moles de urea [(NH2)2CO] se
obtendrán?
2. Según la siguiente reacción
Al reacciónar 6,8 moles de H2S con 24 moles de SO2,
¿Cual es
el reactivo limitante?
¿Cuál es el reactivo en exceso?
¿Cuántas moles de
azufre se producen?
Paso 3: Reste la masa inicial del reactivo en exceso con la masa del reactivo en exceso consumido.
CÁLCULOS DE REACTIVO LIMITANTE A PARTIR DE GRAMOS
Ejemplo:
Haces reaccionar 21,3 g de nitrato de plata con 33,5 g de cloruro de aluminio para preparar cloruro de plata y nitrato de aluminio.
a. ¿Cuál es el reactivo limitante?
b. ¿Cuantos gramos del reactivo en exceso sobran?
c. ¿Cuantos gramos de cloruro de plata se produce?
a. ¿Cuál es el reactivo limitante?
b. ¿Cuantos gramos del reactivo en exceso sobran?
c. ¿Cuantos gramos de cloruro de plata se produce?
Paso 1: Halla las masas molares de los reactivos ( cálculos estequiometricos)
Paso 2: Convierta las masas de los reactivos a moles utilizando la siguiente ecuación
Moles de sustancia = Masa de la sustancia en gramos/Masa molar de la sustancia
Paso 3: Divide la cantidad de moles que te dan de cada reactivo por el número de moles de ese reactivo (Coeficiente) que se usan en la ecuación ajustada, para determinar la cantidad de cada reactivo para la ecuación química especifica.
Paso 2: Convierta las masas de los reactivos a moles utilizando la siguiente ecuación
Moles de sustancia = Masa de la sustancia en gramos/Masa molar de la sustancia
Paso 3: Divide la cantidad de moles que te dan de cada reactivo por el número de moles de ese reactivo (Coeficiente) que se usan en la ecuación ajustada, para determinar la cantidad de cada reactivo para la ecuación química especifica.
R/ El reactivo limitante es el AgNO3 por que es el que se encuentra en menor cantidad
Parte b
Parte b
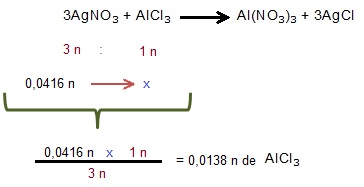
Paso 1: Plantee una regla de tres teniendo en cuentas la relación molar de los reactivos y las moles del reactivo limitante, para hallar las moles del reactivo en exceso que se consumio.
Paso 2: Transforme las moles del reactivo en exceso consumido en gramos utilizando la siguiente formula.
Masa de la sustancia en gramos = Moles de sustancia x Masa molar de la sustancia
masa inicial del reactivo en exceso - masa del reactivo en exceso consumido.
33,5 g de cloruro de aluminio - 1,358 g de Cloruro de Aluminio
32,142 g de Cloruro de Aluminio
Parte c :
Paso 1: Se multiplican las moles del reactivo limitante con el coeficiente del producto que se desea
Paso 2: Convierte las moles del producto en gramos del producto aplicando la formula
Masa de la sustancia en gramos = Moles de sustancia x Masa molar de la sustancia
Actividad 2
1. Se hacen reaccionar
de 3,00 g de antimonio y 2,00 g de cloro, según se muestra en la ecuación
a. Indica cual es el reactivo limitante
b. ¿Cuál es la masa de SbCl3 que se forma al finalizar
la reacción?
c. ¿Cuantos gramos de reactivo en exceso no reaccionaron?
(Pesos
Atómicos: Sb = 121,8, Cl = 35,45)
2. Considerar
la siguiente reacción:
MnO2 (s) +
4 HCl (ac) → MnCl2 (ac) + Cl2 (g) + 2 H2O
(l)
Al inicio se ponen a reaccionar 4.5 g de MnO2 con 4.0 g
de HCl.
a. ¿Cuántos gramos de Cl2 se obtienen?
b. Calcular la cantidad de reactivo en exceso que queda sin reaccionar.
c. ¿Cuál es el reactivo limitante?
3. En la reaccion:
H2SO4 + 2KOH ---> K2SO2 +
2H2 O
Si se tienen 48 gramos de H2SO4 y 60 gramos de KOH Hallar:
a. Reactivo
límite
b. Reactivo en
exceso sin reaccionar
c. Gramos de K2SO2
4. En la reacción
MnO2 + 4HCl → MnCl2 + Cl2 + 2 H2O
Reaccionaron
220 gramos de MnO2 con 240 gramos de HCl.
a. ¿Cuál es el reactivo límite?
b. ¿Cuántos gramos del
reactivo en exceso no reaccionaron?
c. ¿Cuántos gramos de
agua se producen?












No hay comentarios.:
Publicar un comentario